Il virus della PRRS viene eliminato dagli animali infetti attraverso secrezioni nasali, saliva, urina, feci, sangue, latte e sperma. La durata dell'eliminazione varia a seconda del tipo di secrezione, dell'età dell'animale, dello stato immunitario e del ceppo specifico di PRRS. Il virus può persistere per lunghi periodi nel tessuto linfoide (sono stati segnalati casi fino a 251 giorni dopo l'infezione nelle tonsille), anche mesi dopo la scomparsa della viremia.
In un programma di controllo della PRRS, è essenziale selezionare tipologie di campioni e tecniche di campionamento che consentano l'individuazione di animali portatori nelle fasi finali dell'eliminazione, privilegiando il tessuto linfoide e la saliva.

Lo sviluppo di tecniche di campionamento del fluido orale ha rappresentato un progresso significativo nell'aumento della capacità di rilevamento, soprattutto in situazioni di bassa prevalenza e in fasi avanzate dell'infezione. Tuttavia, la presenza di inibitori in questo tipo di campione richiede una conservazione ottimale del campione prima della RT-qPCR. D'altra parte, i valori di cT sono solitamente elevati, il che limita l'ottenimento della sequenza virale.
Il metodo di raschiamento tonsillare descritto alcuni anni fa presentava un limite significativo: richiedeva l'abrasione della tonsilla per ottenere un essudato tonsillare, operazione eseguita con strumenti come cucchiai, rendendone difficile l'applicazione pratica negli animali vivi. Nel 2024, Peng Li (Università dell'Iowa) ha pubblicato un adattamento del metodo di raschiamento con una tecnica meno invasiva chiamata strofinamento tonsillare, o tampone tonsillare, dimostrando una maggiore capacità di rilevare il virus rispetto ai campioni di siero di scrofe infette.
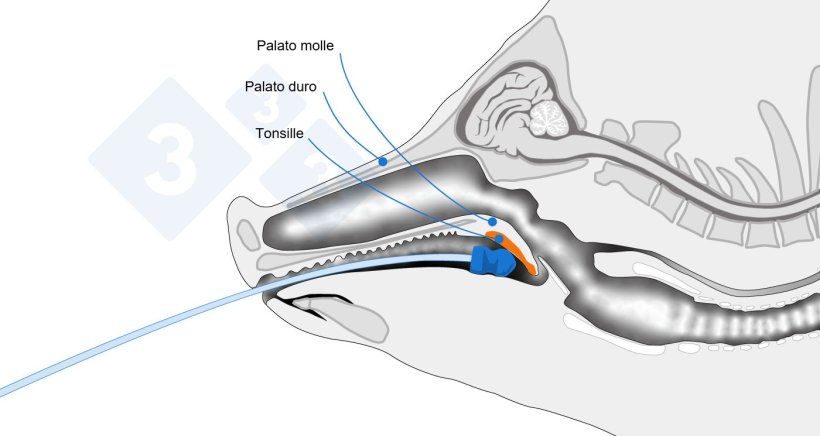
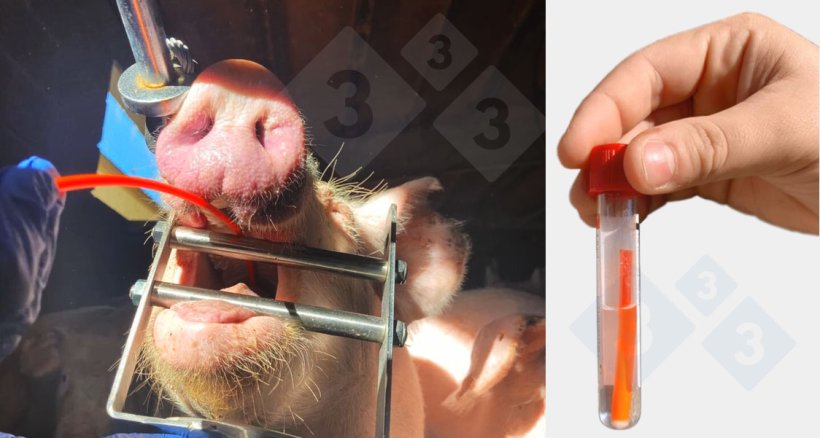
Questo metodo è stato successivamente valutato in diversi allevamenti in Aragona e Catalogna, seguendo il protocollo descritto da Peng Li (2024), con alcune modifiche. Sono stati utilizzati anche cateteri per inseminazione con punta a spugna, come descritto da Peng Li, ma sono state introdotte le seguenti varianti:
- Non è stata utilizzata garza per fissare la punta del catetere.
- L'animale è stato immobilizzato durante il campionamento per facilitare il prelievo diretto delle tonsille, che sarebbe stato difficile in animali in movimento.
- I campioni sono stati raccolti in provette Falcon per l'elaborazione.
Lo studio è stato condotto su due tipologie di allevamenti:
- Allevamento di ingrasso con suinetti infetti naturalmente durante il periodo di svezzamento.
- Allevamento destinato all'accrescimento delle scrofette di selezione,riproduttrici, già infettate naturalmente durante la fase di svezzamento, con l'obiettivo di individuare i portatori cronici e prevenire l'introduzione del virus durante il trasferimento negli allevamenti di produzione.
Nel primo allevamento, il box è stato considerato l'unità epidemiologica. Da ciascun box sono stati selezionati 5 animali per il prelievo simultaneo di sangue e tampone tonsillare, oltre a un campione di fluido orale di gruppo.
L'obiettivo dello studio era stimare la capacità di rilevamento (assenza o presenza) a livello di gruppo utilizzando campioni di sangue combinati, tamponi tonsillari e fluidi orali.
Negli altri due allevamenti, sono stati raccolti campioni individuali di siero, raschiamento tracheobronchiale e tamponi tonsillari, e i risultati analitici sono stati confrontati per ciascun animale.

Tutti i campioni sono stati analizzati mediante RT-qPCR, con valori di cT < 40 considerati positivi. È stato inoltre confrontato il grado di positività (carica virale) di ciascun tipo di campione.
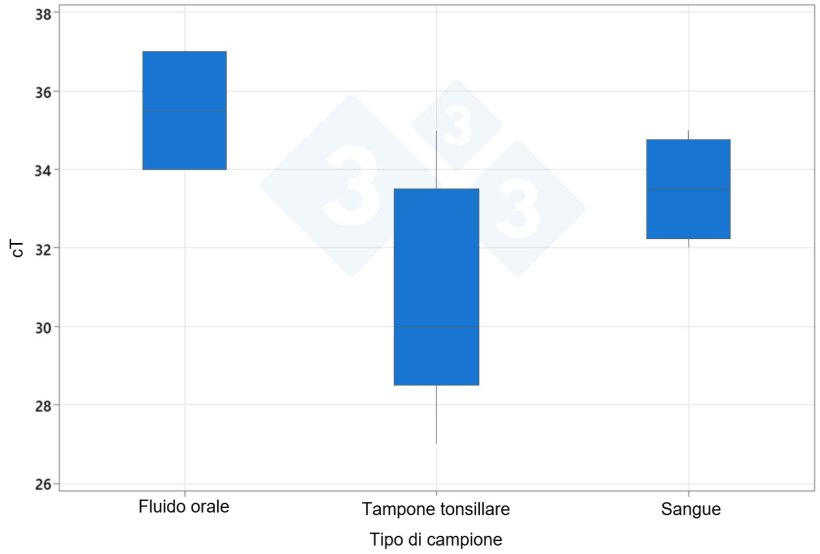
I risultati hanno mostrato che i tamponi tonsillari hanno rilevato una percentuale maggiore di gruppi positivi (100%) per il virus PRRS rispetto ai campioni di raschiamento orotonsillare ottenuti a 140 giorni di età e rispetto ai risultati ottenuti con siero e fluidi orali (66,6%). Inoltre, i tamponi tonsillari positivi presentavano un valore medio di cT inferiore (30,7) rispetto al siero (35,6) e ai fluidi orali (35,5).
Tasso di rilevamento del PRRSV
| Tipi di campione | 10 settimane | 20 settimane |
|---|---|---|
| Sangue | 100 % | 65,51 % |
| Fluido orale | 100 % | 65,51 % |
| Tampone tonsillare | 100% |
Valore medio ct del PRRSV
| Tipi di campione | 10 settimane | 20 settimane |
|---|---|---|
| Siero | 23,16 | 35,67 |
| Fluido orale | 27,00 | 37,00 |
| Tampone tonsillare | 30,67 |
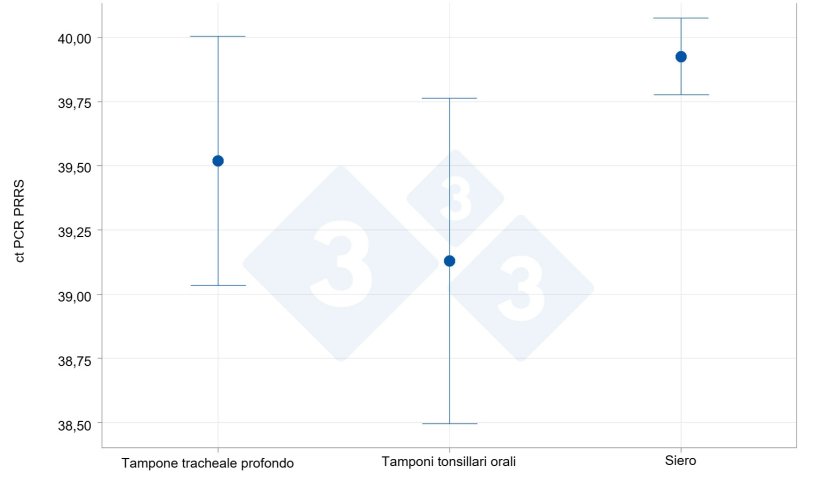
Nello studio condotto su singoli animali cronicamente infetti, i tassi di rilevamento sono stati più elevati nei tamponi tonsillari (61,5%) rispetto al siero (7,7%) e ai raschiati tracheobronchiali (30,8%). La carica virale media dei campioni positivi è stata più elevata nei tamponi tonsillari e nei lavaggi tracheobronchiali (cT 34,1 e 33,0, rispettivamente) rispetto ai pochi campioni di siero positivi (cT 36,0).
| Campione | Negativi | Positivi | Ct medio |
|---|---|---|---|
| Raschiamento tracheobronchiale | 50 (33,56%) | 4 (30,77%) | 33,50 |
| Tampone tonsillare | 46 (30,87%) | 8 (61,54%) | 34,13 |
| Siero | 53 (35,57%) | 1 (7,69%) | 36,00 |
Questa nuova tecnica di campionamento potrebbe fornire uno strumento utile per comprendere meglio le dinamiche dell'infezione nelle scrofe infette da ceppi virulenti, data la prolungata diffusione virale osservabile, soprattutto in prossimità del parto, e il suo potenziale ruolo nella trasmissione del virus alla prole.
Nel prossimo futuro, la sua utilità potrà essere valutata in altri scenari, come l'acclimatazione delle scrofette, l'eliminazione degli animali portatori nei programmi di eradicazione e la sua capacità di rilevare e monitorare altri patogeni come il Mycoplasma hyopneumoniae o il virus dell'influenza suina.



